1. Introduction
Malgré l’accumulation des preuves liant la dyslipidémie et la maladie coronaire, le dépistage et le traitement des dyslipidémies restent un moyen sous-utilisé de réduire le risque coronarien. Par exemple, l’étude ARIC a montré que seulement 42 % des sujets avec augmentation du cholestérol total se savaient hypercholestérolémiques, alors que 84 % des hypertendus se savaient hypertendus [1].
Seulement 4 % des sujets hypercholestérolémiques étaient traités et leur hypercholestérolémie contrôlée, contre 50 % des sujets hypertendus. En France, il a été démontré, dans l’étude d’Epernon, que 13,4 % des sujets connaissaient leur hypercholestérolémie et 65.6 %, leur chiffre de tension artérielle [2].
Les estimations du nombre de patients traités sont différentes en France par rapport aux autres pays, dans la mesure où il existe environ 3 millions de sujets traités pour hyperlipidémie. En revanche, il n’existe pas de données permettant d’évaluer le pourcentage de sujets traités à bon escient ou selon les recommandations de l’ANAES.
2. Justification pour la prise en charge des patients dyslipidémiques
2.1 Relation entre cholestérolémie totale et maladie coronaire
Les preuves de ce lien viennent d’études épidémiologiques d’observation, d’études génétiques, expérimentales et d’essais thérapeutiques.
La relation entre cholestérolémie et maladie coronaire a été mise en évidence dans de nombreuses études épidémiologiques, par exemple, l’étude des sept pays [3], le Multiple Risk Factor Intervention Trial [4], l’étude de Framingham [5] ou l’étude prospective parisienne [6].
Le pouvoir prédictif du chiffre de cholestérolémie varie suivant les sujets.
Il est particulièrement important chez les sujets en prévention secondaire.
2.2 Relation entre cholestérolémie des HDL et maladie coronaire
Une relation inverse forte entre cholestérolémie des HDL et risque de maladie coronaire a été démontrée dans de nombreuses études épidémiologiques, notamment dans celle de Framingham [7].
Dans une analyse de quatre études prospectives américaines, une augmentation du HDL-cholestérol de 0,01 g/l était associée à une diminution du risque coronaire, significative, de 2 % chez les hommes, et de 3 % chez les femmes [8].
2.3 Relation entre triglycéridémie et maladie coronaire
En analyse univariée, de nombreuses études prospectives ont montré une relation directe entre la triglycéridémie et l’incidence de la maladie coronaire, mais cette relation tend à s’atténuer dans les analyses multivariées, qui prennent en compte d’autres facteurs de risque tels que l’hypertension artérielle, la sédentarité, l’obésité, le HDL-cholestérol, les facteurs de coagulation ou les anomalies du métabolisme du glucose.
Une méta-analyse récente (cf infra) suggère que les triglycérides jouent un rôle additionnel aux autres facteurs de risque classiques (dont le HDL-cholestérol). À ce jour, il n’existe pas de preuve directe que le traitement de la seule hypertriglycéridémie s’accompagne d’une diminution du risque vasculaire, sans effet secondaire qui en occulterait l’intérêt.
Des essais thérapeutiques construits pour étudier spécifiquement l’impact de l’augmentation du HDL-cholestérol sur la morbi-mortalité coronaire sont nécessaires.
2.4 Essais thérapeutiques en prévention primaire
2.4.1 Diététique
Ces études posent de très difficiles problèmes méthodologiques :
- difficulté du double aveugle et fréquence des modifications dans le groupe contrôle ;
- nombre de « perdus de vue » souvent plus important que dans les études médicamenteuses. et observance plus aléatoire et difficile à contrôler ;
- difficulté à étudier séparément chaque modification alimentaire (par exemple, la diminution de la consommation de graisses alimentaires s’accompagne automatiquement d’une augmentation du rapport graisses polyinsaturées/saturées [P/S]) ;
- fréquence des études où d’autres facteurs de risque ont été, volontairement ou non, modifiés (tabac) ;
- difficulté de l’interprétation de l’effet non univoque des modifications alimentaires qui entraînent parallèlement des modifications de l’hémostase, de la tension artérielle et, éventuellement, du poids ;
- baisse du cholestérol plus modeste que dans les études médicamenteuses, expliquant la nécessité de travailler sur de grands effectifs.
Malgré ces difficultés méthodologiques, dans la grande majorité des études, la tendance est à la diminution de la fréquence des coronaropathies ischémiques [9] [10] [11] [12] [13] [14] [15].
L’étude de Los Angeles (Los Angeles Veterans Administration Study) [9] est une étude de prévention primaire, menée en double aveugle, comparant deux types de régime :
- d’une part, 40 % de calories provenant des graisses, 650 mg de cholestérol et un rapport acides gras polyinsaturés/saturés [PIS] de 0.3-0,4
- et, d’autre part, 365 mg de cholestérol et un rapport P/S de 1,7.
Dans le groupe contrôle (422 hommes), 65 sont décédés (mort subite et infarctus) et, dans le groupe traité (424 hommes), 52 sont décédés des mêmes causes. La différence n’est pas significative et le devient seulement si on englobe l’ensemble des morts d’origine cardiovasculaire. Cette étude n’est pas exempte de critiques nombre de « perdus de vue », supérieur à 10 % dans le groupe traité, mélange de sujets sains et de sujets présentant des antécédents cardiovasculaires, observance médiocre du régime dans le groupe traité.
Il s’agit d’une des deux études où la fréquence des cancers est augmentée : cette différence est toutefois non significative et concerne, pour la majorité, des patients qui n’ont pas suivi de régime.
Dans l’étude des hôpitaux psychiatriques finlandais (Finnish Diet Study) [10], deux régimes différant par leur composition en graisses saturées ont été comparés pendant une période de deux fois 6 ans en cross-over. Une diminution des coronaropathies ischémiques a été observée dans le groupe sous régime riche en graisses insaturées.
Enfin, l’étude Minnesota Coronary Survey ne montre globalement pas de diminution des événements coronaires, malgré des effectifs plus importants, mais le suivi a été particulièrement court (1 an) [11].
2.4.2 Médicaments
Dans le Lipid Research Clinics Coronary Primary Prevention Trial) [16], 3 806 hommes, âgés de 35 à 59 ans, indemnes de coronaropathies, et dont la cholestérolémie était d’au moins 2,6 g/l, ont été randomisés pour recevoir soit des conseils diététiques seuls, soit des conseils diététiques et de la cholestyramine, à la dose de 24 g par jour.
Le suivi moyen a été de 7,4 ans.
La fréquence de l’événement combiné (décès coronarien-infarctus du myocarde non fatal) a été diminuée de 19 % dans le groupe sous cholestyramine.
L’étude d’Helsinki [17] a randomisé 4081 hommes, indemnes de coronaropathies, et ayant un cholestérol des LDL et des VLDL (appelé « non HDL-cholestérol ») supérieur à 2 g/l, pour recevoir du gemfibrozil, 1 200 mg par jour, ou son placebo, pendant 5 ans.
La fréquence de l’événement combiné (décès cardiaque-infarctus du myocarde fatal ou non fatal) a été diminuée de 34 %.
Ces deux études n’ont pas mis en évidence de réduction de la mortalité globale, mais il est admis que les effectifs n’étaient pas suffisants.
Ces résultats et ceux de l’étude de l’OMS [18] ont toutefois contribué à alimenter la polémique sur le bénéfice de la baisse thérapeutique de la cholestérolémie.
En effet, l’étude de l’OMS a permis de comparer l’évolution de la mortalité et de la morbidité dans un groupe sous placebo, et dans un groupe traité par clofibrate (1,6 g par jour).
Plus de 10 000 hommes âgés de 35 à 59 ans, indemnes de coronaropathies, et ayant une cholestérolémie dans le tercile supérieur de la distribution ont été inclus dans l’étude.
Les résultats importants de cette étude sont, d’une part, la confirmation de la diminution de la mortalité coronaire sous clofibrate (diminution relative de 20 %) mais, d’autre part, un effet négatif sur la mortalité totale. Cet effet négatif est surtout dû à un excès de mortalité par maladies du foie, de la vésicule biliaire et de l’intestin.
Les méta-analyses permettent une analyse de l’ensemble des données publiées, mais n’incluent pas, le plus souvent, les essais les plus récents. Elles peuvent donner des résultats contradictoires suivant la méthodologie utilisée.
Dans la méta-analyse de Muldoon, qui regroupe six essais en prévention primaire, testant la diététique ou un médicament [19], la mortalité d’origine coronaire était réduite de 15 % (p = 0,06), mais sans diminution significative de la mortalité totale.
L’étude WOSCOPS a été réalisée en double aveugle (placebo versus 40 mg de pravastatine) chez 6 595 hommes de l’ouest de l’Écosse, âgés de 45 à 64 ans, indemnes d’infarctus du myocarde, et dont la cholestérolémie moyenne était de 2,72 ± 0,23 g/l (7,0 ± 0,6 mmol/l) [20].
Le suivi a été de 4,9 ans.
La diminution de 26 % du LDL-cholestérol (et 20 % du cholestérol total) s’est accompagnée d’une diminution très significative de la fréquence de l’événement combiné décès coronaire-infarctus non fatal (174 versus 248, soit une baisse de 31 % p < 0,001), d’une réduction de la mortalité cardiovasculaire (50 versus 73, soit une baisse de 32 % p = 0,033) et d’une réduction de 22 % de la mortalité totale (106 versus 135 ; p = 0.051 et 0.039, après ajustement sur les facteurs de risque à l’entrée dans l’étude).
Enfin l’étude AFCAPS/TexCAPS a été réalisée avec la lovastatine, et montre le bénéfice du traitement dans une population dont le taux de cholestérol était proche des valeurs usuelles de la population française, mais avec un risque vasculaire augmenté du fait du pays d’origine (Etats-Unis) et d’une sélection sur des critères de HDL-cholestérol bas.
La diminution des événements cardiovasculaires est de 37 % sans diminution significative de la mortalité totale (qui a été de toute façon faible dans cette étude).
2.5 Essais thérapeutiques en prévention secondaire
2.5.1 Les régimes
Dans la Oslo Heart Study [12], 412 hommes ont été randomisés, un à deux ans après un infarctus. Dans le groupe expérimental était préconisé un régime pauvre en graisses saturées et en cholestérol, et riche en graisses polyinsaturées.
La réduction de la cholestérolémie a été de 18 % dans le groupe expérimental et de 4 % dans le groupe contrôle (p < 0,05). A 11 ans, il existait une réduction de la mortalité cardiaque (41 % versus 49% p = 0,1) et du taux de récidives fatales d’infarctus (19 % versus 33 %: p = 0,004).
En revanche, il n’y avait pas de différence significative entre les deux groupes, en ce qui concerne la mortalité globale.
Malgré l’existence de facteurs confondants (anticoagulants plus fréquents dans le groupe expérimental, sujets âgés de plus de 60 ans plus nombreux dans le groupe contrôle), ce régime a été considéré comme efficace en prévention secondaire de l’infarctus.
L’essai indien [13] est un essai d’intervention précoce 406 patients ont été randomisés 24 à 48 heures après un infarctus.
Le groupe expérimental recevait un régime enrichi en fruits, en légumes, en noix, en céréales et en poisson.
Dans le groupe expérimental, la cholestérolémie totale, le LDL-cholestérol et la triglycéridémie ont diminué de façon significative (p <0,02), sans variation significative du HDL-cholestérol.
A un an, il y avait une diminution de la mortalité globale (risque relatif : 0,55), de la mortalité cardiaque (risque relatif : 0,58) et du taux de récidives non mortelles d’infarctus (risque relatif : 0,621) (tableau 1).
Tableau I. Résultats à un an dans l’essai indien (Singh R.B. et coll. Am J Cardiol 1992 ; 69 : 879-85.)
Mortalité globale (%)
Mortalité cardiaque (%)
Infarctus non fatals (%)
Mortalité ou infarctus non fatals (%)
Groupe expérimental
10,3
10,2
14,7
24,5
Groupe contrôle
18,8
16,8
23,8
40,6
Risque Relatif (IC à 95%)
0,55 (0,34-0,75)
0,58 (0,34-0,83)
0,62 (0,42-0,83)
0,59 (0,46-0,74)
Certains régimes améliorent le pronostic après un infarctus, sans modifier les taux des lipides sanguins.
L’étude DART [14] a porté sur 2 033 hommes, victimes d’infarctus et randomisés pour recevoir ou non des conseils diététiques concernant les trois régimes suivants :
- régime portant sur les graisses : diminution des graisses à 30 % de la ration énergétique totale ; augmentation des graisses polyinsaturées pour avoir un rapport graisses polyinsaturées/saturées égal à 1 ;
- régime portant sur les poissons : augmentation de la consommation de poisson gras (au moins deux repas par semaine) ;
- régime portant sur les fibres : augmentation de la consommation de fibres (18 g par jour). Quel que soit le régime recommandé, il n’y a pas eu de diminution de la cholestérolémie.
Il faut noter que la cholestérolémie à l’entrée dans l’étude était basse : 6,5 mmol/l (2.5 g/l) en moyenne.
Seul le régime préconisant une augmentation de la consommation de poisson a montré une diminution de la mortalité globale de 29 % (p < 0,05) pendant les deux ans de l’étude.
Un an après l’arrêt de l’étude, lorsque les habitudes alimentaires antérieures avaient été reprises, la mortalité a à nouveau augmenté dans le groupe expérimental.
L’étude lyonnaise [15] a comparé les effets d’un régime classique à un régime méditerranéen riche en pain, en fruits et légumes, en poisson et, par ailleurs, comprenant moins de viande, de beurre et de crème.
Les graisses de ce régime méditerranéen étaient remplacées soit par de l’huile d’olive, soit par une margarine dont la composition était comparable à celle de l’huile d’olive, aboutissant à un régime riche en acide alpha-linolénique, précurseur des acides gras à chaîne longue de la série oméga 3.
Le régime classique est celui préconisé après infarctus par l’American Heart Association (lipides = 30 % de l’apport énergétique total ; graisses saturées = 10 % ; rapport graisses polyinsaturées/graisses saturées = 0,8).
Cet essai de prévention secondaire après infarctus, en simple aveugle, a porté sur 605 patients et a duré 5 ans.
Il n’a pas été noté de différence entre les deux groupes, en ce qui concerne les taux de cholestérol total, de triglycérides, de lipoprotéines, d’apoprotéines ou de Lp(a) (il semble que d’autres éléments interviennent : effet antiarythmique, effet antithrombotique…).
Néanmoins, on notait une tendance à l’augmentation du HDL-cholestérol et à une diminution du LDL-cholestérol.
L’événement combiné mortalité cardiovasculaire-infarctus non fatal (objectif principal), après un suivi moyen de 27 mois, était significativement moins fréquent dans le groupe expérimental que dans le groupe témoin : 5,3 % versus 21,3 % (p < 0,001) (figure 1).
La mortalité globale était également diminuée : 4,5 % versus 18% (p = 0,02).
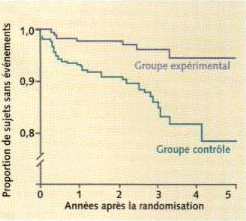
figure 1
Evènements combinés : décès de cause cardiaque-infarctus du myocarde non fatals dans l’essai lyonnais (De Lorgeril M. et coll. Lancet 1994 ; 343 : 1454-9).
2.5.2 Les médicaments
Avant 1994, il n’existait qu’un seul essai puissant, le Coronary Drug Project [21].
Cette étude multicentrique, randomisée, en double aveugle, a inclus 8341 hommes de 30 à 64 ans.
Six traitements ont été testés : estrogènes conjugués. 2,5 mg par jour ; estrogènes conjugués 5 mg par jour ; D-thyroxine, 6 mg par jour ; clofibrate, 1,8 mg par jour ; acide nicotinique, 3 g par jour ; placebo.
La partie de l’étude portant sur les estrogènes et sur la D-thyroxine a dû être arrêtée rapidement en raison d’une augmentation de la fréquence des coronaropathies.
Après un suivi de 5 ans, la cholestérolémie était diminuée de 6,5 % avec le clofibrate, et de 10 % avec l’acide nicotinique. Ni le clofibrate, ni l’acide nicotinique n’ont montré d’efficacité sur la mortalité globale, ce qui était l’objectif principal de l’étude.
Il a été noté dans le groupe acide nicotinique une diminution significative des récidives non fatales d’infarctus (8,9 % versus 12,2 % ; p < 0,005).
Neuf ans après l’arrêt de l’étude, après un suivi total de 15 ans [22], la mortalité globale était inférieure de 11 % dans le groupe acide nicotinique par rapport au groupe placebo (p = 0,0004). Cette réduction de la mortalité globale semblait due à une réduction de la mortalité cardiovasculaire.
En 1990, Rossouw a publié une méta-analyse de huit études de prévention secondaire après infarctus [23].
Un traitement hypolipémiant (médicament ou régime) entraînait une réduction significative des infarctus fatals (p < 0,01), des infarctus non fatals (p < 0,001), de tous les infarctus (p < 01001), et de la mortalité cardio-vasculaire (p < 0,05).
Il ressort de cette méta-analyse que, en prévention secondaire après un infarctus, une réduction moyenne de la cholestérolémie de 10 % conduirait à une réduction de 19 % du nombre d’infarctus non fatals, de 12 % du nombre d’infarctus fatals, et de 15 % du nombre de tous les infarctus.
Il n’y a pas de diminution de la mortalité globale.
Un peu à part, l’étude POSCH [24], dans laquelle les patients ayant des antécédents d’infarctus avaient subi une dérivation iléale partielle afin de réduire le LDL-cholestérol (réduction de 38 %), a fait apparaître sur cinq ans une réduction, significative, de 35 % de l’événement combiné mortalité coronaire-infarctus non fatal.
Malgré son efficacité, le traitement utilisé est toutefois associé à beaucoup d’effets secondaires, en particulier digestifs, qui le rendent peu applicable, malgré les résultats positifs de l’étude.
L’étude 4S [25] est un essai thérapeutique randomisé, multicentrique, en double aveugle, qui a porté sur 4 444 hommes et femmes, âgés de 35 à 70 ans, ayant des antécédents d’angor ou d’infarctus, et ayant une cholestérolémie modérément élevée après huit semaines de régime adapté (5,5-8 mmol/l [2,1-3,1 g/l).
Les patients ayant des antécédents d’infarctus compliqués d’un dysfonctionnement myocardique important ou nécessitant un traitement médicamenteux pour insuffisance cardiaque ont été exclus de l’étude, ce qui a amené à sélectionner des patients à plus faible risque que ceux que l’on rencontre habituellement après infarctus.
Les patients présentant une hypertriglycéridémie ont également été exclus de l’étude (la triglycéridémie devait être inférieure à 2,5 mmol/l [2,18 g/l]).
Le traitement avait pour objectif de réduire la cholestérolémie totale à des valeurs comprises entre 3 et 5,2 mmol/l (1,2-2.0 g/l).
La simvastatine (20 à 40 mg par jour) a diminué la cholestérolémie totale de 25 %, le LDL-cholestérol de 35 %, et a augmenté le HDL-cholestérol de 8 %.
Après un suivi moyen de 5.4 ans, le traitement réduisait significativement la mortalité globale, objectif principal de l’étude (8 % versus 12 % , p = 0,0003).
La fréquence de l’événement combiné décès d’origine coronaire-infarctus non fatal-infarctus silencieux-arrêt cardiaque ressuscité a été également diminuée (19% versus 28% ; p <0,00001). Le bénéfice obtenu ne semblait pas dépendre de la cholestérolémie initiale.
Les résultats de l’étude CARE [26] étendent les résultats de 4S à des patients moins hypercholestérolémiques (cholestérol total < 6,2 mmol/l [2,4 g/l] ; LDL-cholestérol entre 3 et 4,5 mmol/l [1,2-1,8 g/l).
Dans cette étude, 4159 hommes et femmes de 21 à 75 ans ont été randomisés, 3 à 20 mois après un infarctus, pour recevoir soit 40 mg de pravastatine par jour, soit un placebo.
Le critère de jugement principal associait mortalité coronaire et infarctus non fatal (événement combiné).
Le suivi a été de 5 ans. Le risque de l’événement combiné a été réduit de 24 % dans le groupe pravastatine (10,2 % versus 13,2 % p = 0,003). Les courbes de Kaplan-Meier divergent dès la deuxième année. Cette réduction du risque se retrouve chez les hommes comme chez les femmes, chez les sujets âgés, chez les sujets hypertendus, diabétiques, fumeurs, ou ayant une fraction d’éjection ventriculaire gauche supérieure à40 %, ou abaissée (entre 25 et 40 %).
En revanche, la réduction du risque est influencée par le LDL-cholestérol initial : il semble que le bénéfice soit moindre pour les valeurs de LDL-cholestérol les plus basses (tableau II).
Tableau II. Réduction du risque en fonction du LDL-cholestérol initial dans l’étude CARE (Sachs F.M. et coll. N Engl J Med 1996 ; 335 : 1001.)
Taux initial de LDL-C mmol/l (g/l)
Pourcentage d’évènements
Pourcentage de la réduction du risque (IC à 95%)
> 3,9 (1,5)
3,2-3,9 (1,3-1,5)
< 3,2 (1,3)
Groupe prava*
21
20
22
Groupe PCB**
31
27
21
Groupe prava*
35 (17-50)
26 (13-38)
-3 (-38-23)
Groupe PCB**
0,008
<0,001
NS
* pravastatine ; ** placebo
L’étude LIPID (Long Term Intervention with Pravastatin in Ischaemic Disease) (N Engl J Med 1998 ; 339 : 1349-57) menée chez 9014 patients d’Australie et de Nouvelle-Zélande, a été faite en prévention secondaire (après infarctus du myocarde pour 64 % des patients, ou angor instable pour les autres).
Les critères d’inclusion comprenaient la cholestérolémie de 155 à 271 mg/dl, des antécédents soit d’infarctus du myocarde, soit d’angor instable dans les 3 à 36 mois avant l’inclusion (avec stratification sur ce critère) et un âge compris entre 31 et 75 ans.
Les critères d’exclusion étaient l’existence d’une insuffisance cardiaque (NYHA III et IV), une triglycéridémie supérieure à 4,45 g/l (5 mmol/l), une pathologie rénale ou hépatique, et l’utilisation d’un autre hypolipidémiant.
La moitié des sujets ont été randomisés dans le groupe placebo et l’autre moitié dans le groupe traité par 40 mg de pravastatine.
Les patients étaient suivis tous les 6 mois avec un bilan lipidique comprenant le cholestérol, les triglycérides, l’HDL-cholestérol, les apolipoprotéines Al et B au bout de 1, 3 et 5 ans.
Au terme du suivi d’environ 5 ans, il y eut une diminution très significative de la mortalité totale (- 23 % ; p = 0,0001).
Parallèlement, la morbidité coronaire a aussi diminué significativement. Ces études montrent que le bénéfice du traitement de l’hypercholestérolémie est proche de celui obtenu avec d’autres mesures de prévention courantes de la pratique médicale.
À titre indicatif, l’arrêt du tabac en prévention secondaire, avec un suivi de 10,5 ans sur une population de 1306 sujets (55 % ont arrêté et 45 % ont continué de fumer) a entraîné, en termes de décès, une baisse de 23 %, p <0,0001).
Dans une analyse de 25 essais, avec 29000 patients, l’aspirine entraîne une réduction de 20 % de la mortalité à un an, et de 20 % des récidives d’infarctus.
Enfin, les bêtabloquants (méta-analyse du Beta-Blocker Pooling Project) réduisent de 24 % la mortalité à un an, de 31 % la mort subite et de 27 % les récidives d’infarctus.
Enfin, et plus récemment, l’étude GISSI (Lancet 1999 ; 354 : 447-55) montre que les huiles de poisson sont capables de diminuer significativement de 10 % la fréquence des décès, infarctus du myocarde et accidents vasculaires cérébraux combinés.
Le bénéfice a été observé dans une étude ayant inclus 11324 sujets en prévention secondaire randomisés en groupe placebo (n = 2 828), vitamine E (n =2 830), huile de poisson (n = 2836) et vitamine E et huiles de poisson (n = 2 830).
A l’inverse de l’étude CHAOS, la vitamine E n’est associée à aucun bénéfice. Compte tenu de l’effectif important, cela jette un doute sérieux sur l’utilité de la vitamine E en prévention.
Enfin, l’étude VA-HIT (N Engl J Med 1999 ; 341 : 410-8) est une démonstration récente de l’effet du gemfibrozil en prévention secondaire.
Les caractéristiques de la population inclue dans cette étude associaient LDL-cholestérol bas (< 140 mg/dl par inclusion et en moyenne à 113 mg/dl), HDL-cholestérol bas (< 40 mg/dl par inclusion et en moyenne à 32 mg/dl), tendance au surpoids (IMC moyen à 29) et grande fréquence de l’hypertension (57 %) et du diabète (25 %).
Au terme de 5 ans, il y a eu une diminution de 22 % des événements cardiovasculaires dans le groupe traité par rapport au groupe placebo (p = 0,006).
Le bénéfice n’est occulté par aucun effet secondaire. Cette étude est importante car elle montre que cette population, qui semble peu bénéficier des statines (LDL-C bas), bénéficie d’un traitement par fibrate.
2.6 Les études de régression de la plaque d’athérome
Des essais comprenant des populations de patients moins importantes (au maximum quelques centaines) ont eu pour objectif d’évaluer l’effet d’un traitement hypolipidémiant sur la progression et la régression des plaques d’athérome.
Le pourcentage de patients avec régression est plus important dans les groupes recevant un traitement hypolipidémiant que dans les groupes contrôles. Ce résultat ne peut être contesté, mais la régression est minime et contraste avec l’ampleur du bénéfice clinique, et surtout avec la relative précocité du bénéfice observé dans les études dans lesquelles le risque vasculaire de la population est très élevé.
Cet effet rapide a réactualisé le concept de plaque fragile ou vulnérable. En effet, on sait que les plaques les plus petites, les plus riches en monocytes, en lipides et avec la chape fibreuse la plus fine sont les plus en cause dans les accidents coronaires.
D’autres actions, comme celles sur les paramètres de l’hémostase, en particulier la fonction plaquettaire, ou celles sur la fonction endothéliale peuvent être impliquées.
2.7 Importance de la prise en charge d’un individu en fonction de son risque global
L’enseignement important des études récentes est aussi que le bénéfice en termes d’accidents évités est directement fonction du risque de la population.
Le bénéfice est majeur dans une population à haut risque (prévention secondaire, population écossaise), et modeste quand le risque cardiovasculaire est faible, avec une possibilité que le bénéfice soit occulté par des effets secondaires quand le risque est très faible.
En effet, l’analyse des études dans leur ensemble montre que la baisse du nombre d’événements est proche de 30 %. Si on considère des individus dont le risque à 5 ans est faible (par exemple, 3 % d’infarctus myocardiques), il faut traiter environ 100 individus pour éviter un accident. Si on s’adresse à une population à haut risque (par exemple, 21 % d’infarctus myocardiques à 5 ans), il faut traiter environ 14 individus pour éviter un accident.
Il existe un nomogramme permettant de connaître le nombre de sujets à traiter pendant 5 ans pour éviter un événement [27]. Ce nomogramme est une méthode utile pour le médecin, dans la mesure où il lui permet d’évaluer la rentabilité de son intervention. Il ne peut toutefois pas servir de base à des recommandations chiffrées. En effet, on ne sait pas à partir de quel nombre de patients à traiter pour éviter un événement, la prévention n’est plus rentable.
De plus, la notion de « rentabilité » tient obligatoirement compte de l’âge (éviter un infarctus à 20 ans n’a probablement pas la même valeur qu’à 80 ans). Il est donc maintenant indispensable de ne traiter un patient que si l’on connaît approximativement son risque vasculaire absolu.
L’objectif de tous, et en premier lieu des médecins traitants, est donc d’aller dépister les sujets les plus à risque et de les amener progressivement à une prise de conscience et à un traitement.
3. L’équilibre alimentaire comme étape prioritaire dans la prévention
Le caractère presque spectaculaire des résultats obtenus en prévention secondaire aboutit à une sous-estimation de l’importance de l’équilibre alimentaire. Il est même parfois sous-entendu que le traitement peut ou doit être donné d’emblée sans diététique préalable. La sous-estimation de l’importance de la diététique est aussi une conséquence de la polémique qui a conduit, en France, à minimiser le rôle du cholestérol.
Il est indispensable de soumettre systématiquement et, quel que soit le contexte, tous les patients hyperlipidémiques à une diététique hypolipidémiante. Cette recommandation est également valable en prévention secondaire.
Les doutes relatifs à la nécessité de mettre en route une diététique adaptée en prévention secondaire proviennent de la mise en évidence d’un bénéfice rapide des hypolipidémiants (cet effet, retrouvé dans plusieurs études, est particulièrement net dans une étude réalisée avec la pravastatine). Mais la diététique seule en prévention secondaire améliore aussi de façon rapide le pronostic cardiovasculaire, comme l’a montré l’étude de Lyon [15].
Plusieurs arguments plaident fortement en faveur de la diététique :
- toutes les études récentes ou anciennes ont été faites chez des patients ayant préalablement été soumis à une période de diététique appropriée, sans traitement par des médicaments ;
- les essais réalisés avec la diététique montrent une baisse importante du risque vasculaire ;
la diététique permet de normaliser une proportion importante d’hyperlipidémies mineures ; - la diététique entraîne une diminution du risque plus importante que ne le laisserait présager la seule baisse des lipides ;
- prescrire un traitement sans diététique est hors AMM et contraire aux RMO.
L’importance de la diététique est peu controversée chez les sujets hyperlipidémiques. Le lien épidémiologique entre cholestérolémie, accident cardiovasculaire et consommation en corps gras saturés est bien documenté chez l’homme.
Malgré les difficultés méthodologiques, les études diététiques montrent, dans leur grande majorité, une même tendance à la diminution de la fréquence des coronaropathies ischémiques.
De plus, lorsqu’elles sont prises en compte dans les méta-analyses, elles montrent une efficacité identique aux études médicamenteuses pour une même baisse du cholestérol, mais cet effet ne s’accompagne pas d’effet secondaire.
En prévention secondaire, l’étude d’Oslo a montré qu’un régime riche en graisses insaturées s’accompagnait d’une diminution significative du nombre d’accidents coronariens.
Il s’agit d’une étude multifactorielle, mais deux éléments sont importants : la diminution des événements est fonction de l’importance de la baisse du cholestérol sanguin (comprise entre 10 et 24 % dans l’étude) et, en analyse multivariée, 60 % de la réduction des coronaropathies est liée aux modifications du régime alimentaire.
La diététique conseillée dans l’hypercholestérolémie présente plusieurs avantages : les acides gras insaturés ne se limitent pas à leur effet hypolipidémiant. Il est démontré qu’ils sont capables de diminuer le risque de thrombose artérielle. Enfin, le régime riche en graisses insaturées peut exercer un effet bénéfique chez le diabétique.
Le patient doit être amené à la diététique avec une stratégie progressive, plus ou moins rapide suivant les cas.
Il faut, dans un premier temps, diminuer les acides gras saturés et, suivant les patients, le médecin choisira la ou les priorités, par exemple, diminuer ou enlever le beurre et les aliments riches en beurre, puis, si les résultats l’imposent, affiner les conseils, de consultation en consultation.
Chez d’autres, l’action prioritaire sera plutôt de faire diminuer la charcuterie.
Cette stratégie progressive permet aussi de confirmer les anomalies et évite de démotiver les patients.
La question pourrait être posée de l’utilité de la diététique en prévention secondaire où un effet précoce des traitements hypolipémiants a été rapporté, en particulier dans une étude récente réalisée avec la pravastatine.
Dans la pratique, cette alternative ne se pose pas, car les récentes références médicales opposables (RMO) proposent de n’introduire un traitement par un médicament, en prévention secondaire, qu’après trois mois de diététique et si les objectifs thérapeutiques (LDL-cholestérol < 1,3 g/l) n’ont pas été atteints.
Dans ces conditions, tout patient doit être soumis à des recommandations diététiques pour une période minimale de trois mois, et cette attitude est d’autant plus justifiée en post-infarctus immédiat que, très souvent, les paramètres lipidiques sont abaissés pour remonter progressivement à leur valeur de base après un à trois mois.
Cependant, pour les sujets présentant après un mois un taux de LDL-cholestérol supérieur à 1,6 g/l, il est très peu probable qu’une diététique très bien suivie puisse permettre d’atteindre les objectifs recherchés.
Dans cette situation, il est souhaitable d’entreprendre plus précocement un traitement médicamenteux.
En prévention primaire, plusieurs études ont démontré l’intérêt de la diététique. Là aussi, les RMO imposent un délai de six mois de diététique, avant d’entreprendre un traitement par un médicament. Cette attitude parait raisonnable tant il est important d’utiliser la durée pour modifier de manière valable un comportement alimentaire individuel et familial.
Un recours au traitement par un médicament est noté dans les recommandations de l’ANAES, si la diététique est effectivement réalisée et s’avère inefficace.
En l’absence d’étude précise, les critères suggérant qu’une diététique est effectivement réalisée sont moins faciles à définir. Si un amaigrissement était recherché, une réduction pondérale de 5 % du poids idéal peut être considérée arbitrairement comme un résultat satisfaisant. Dans ce cadre, la modification du rapport « taille sur hanche » peut aussi avoir son importance.
Il est plus difficile d’apprécier la qualité des apports, et seule une enquête diététique permettra de vérifier le respect des conseils, en portant une attention particulière sur la quantité et la qualité des graisses ingérées.
Cette approche est difficile à réaliser en médecine générale, mais une réduction de cholestérolémie de 5 % environ peut permettre de conforter les résultats d’une enquête suggérant une bonne adhésion.
Avant de préciser dans le détail les recommandations nutritionnelles, deux points méritent d’être soulignés :
- Tout d’abord, les recommandations de l’ANAES proposent un seuil d’intervention par des médicaments différents des objectifs thérapeutiques en fonction du niveau de risque vasculaire.
Cette attitude est une source d’ambiguïté, et peut être notamment incomprise par les patients n’atteignant pas, malgré des efforts diététiques réels, les objectifs thérapeutiques, mais se situant en dessous des seuils d’intervention par des médicaments.
Le risque vasculaire dans cette zone intermédiaire n’a pas été jugé suffisamment accru pour proposer un traitement dont le coût est en grande partie supporté par la collectivité.
Face à cette situation, deux attitudes peuvent se discuter : soit faire abstraction des objectifs thérapeutiques et ne plus retenir que le seuil d’intervention, soit, en alternative, proposer une attitude diététique beaucoup plus stricte, conformément aux recommandations, mais qui restent particulièrement évasives sur ce point.
Dans ce contexte, il pourrait être souhaitable de définir deux niveaux d’intervention diététique. - Le deuxième point à souligner est l’efficacité de la diététique qui, en moyenne, permet une réduction du LDL-cholestérol de 7 à 10 % pour les régimes habituellement proposés.
Une grande variabilité interindividuelle est en règle générale observée, les meilleures réponses étant notées chez les patients ayant la cholestérolémie la plus élevée.
Les recommandations nutritionnelles pour les patients présentant une hypercholestérolémie sont assez simples et varient finalement assez peu depuis ces vingt dernières années, quoique certaines précisions aient pu être apportées [28].
3.1 Le contrôle du poids
En termes quantitatifs, la recherche d’un poids satisfaisant doit être un objectif prioritaire. Il est désormais couramment admis que l’indice de masse corporelle (IMC) (poids/taille2 £ 27) est un objectif recommandable chez les patients à risque métabolique.
Il faut cependant souligner que la réduction de la cholestérolémie liée seulement à la réduction pondérale est, en règle générale, modeste. Une méta-analyse récente permet de prédire une réduction de 0,0089 g/l du LDL-cholestérol par kg de poids perdu [29].
Cependant, cette relation parait beaucoup plus importante pour les patients ayant un poids et une cholestérolémie élevés. Pour les patients obèses dont le HDL-cholestérol est bas, l’amaigrissement permettra partiellement sa correction.
Il n’y a pas de règles précises pour évaluer la quantité calorique à apporter dans la recherche d’un amaigrissement.
Certaines équipes proposent une réduction de 400 à 600 kCal/j à partir des données de l’enquête diététique, d’autres définissent une réduction à peu près équivalente, mais à partir de la dépense énergétique de base, estimée par des équations préalablement validées.
Enfin, d’autres proposent une règle empirique variant le régime en fonction de l’apport calorique, estimé entre 1200 et 1600 kCal/j.
3.2 L’apport lipidique
En termes qualitatifs, l’élément fondamental est la réduction de la consommation des graisses saturées [30], qui, bien plus que le cholestérol alimentaire [31], sont déterminantes pour préciser le niveau de la cholestérolémie.
Parmi les différents acides gras saturés, l’acide stéarique semble avoir une position particulière puisque, contrairement aux acides myristique, laurique (les deux étant surtout présents dans le beurre) et palmitique, il serait relativement neutre vis-à-vis du LDL-cholestérol.
L’objectif est de rapporter la consommation d’acides gras saturés à 10 % maximum de la ration calorique totale. Cet objectif peut être atteint en réduisant l’apport lipidique global à 30 % de la ration calorique totale.
L’autre élément déterminant est la recommandation d’un apport d’acides gras polyinsaturés égal voire supérieur à 10 % de la ration calorique totale.
Cette affirmation a été modulée, ces quelques dernières années, sur différents arguments :
- En effet, des apports aussi élevés peuvent être responsables d’une réduction du HDL-cholestérol, dont le rôle pathogène est discuté mais qui, a priori, dans l’état actuel des connaissances, est probablement délétère.
- De plus, I’oxydabilité importante de ces acides gras pourrait augmenter notamment s’ils sont consommés en excès, en favorisant le développement de l’athérosclérose, et éventuellement de certains cancers.
Un apport situé entre 4 et 10 % de l’apport calorique total est actuellement recommandé par plusieurs organisations internationales. Il a été également suggéré d’apporter la plus grande quantité d’acides gras polyinsaturés chez les sujets consommant préalablement de grandes quantités d’acides gras.
Deux grandes classes d’acides gras, en fonction de la position de la première double liaison, représentent cette classe d’acides gras polyinsaturés :
- Les acides gras de la série oméga 6, surtout représentés par l’acide linoléique, sont essentiellement présents dans les végétaux.
- L’acide alpha-linolénique (série oméga 3), présent à de plus faibles quantités, jouerait un rôle fondamental dans la prévention cardiovasculaire. Ce rôle a été suggéré récemment dans l’étude lyonnaise de prévention secondaire, et ne semble pas passer par une réduction des paramètres lipidiques, mais pourrait faire intervenir des phénomènes thrombotiques ou antiagrégants et hémorréologiques.
Les acides gras de la série oméga 3 des produits marins, particulièrement les huiles de poisson des mers froides (DHA et EPA), auraient également un grand intérêt, mais exposeraient, plus particulièrement à doses élevées, aux problèmes liés à l’excès d’oxydabilité. Une grande partie de leur action ne serait pas également liée à des variations des paramètres lipidiques.
L’apport calorique lipidique restant devra être effectué par la consommation d’acides gras monoinsaturés, qui, dans différents travaux récents, n’ont pas d’effet sur le HDL-cholestérol ni sur le LDL-cholestérol, quoique dans certaines études il ait pu être abaissé par des consommations importantes de ces acides gras. L’acide oléique représente l’essentiel de cette classe d’acides gras.
L’hydrogénation de l’acide linoléique lors de la formation industrielle des margarines dures (emballage papier, par opposition aux margarines à tartiner en barquette) provoque la formation d’acide élaïdique (acide gras trans) qui est un stéréo-isomère de l’acide oléique. Cet acide gras, ingéré à fortes doses, pourrait augmenter la cholestérolémie.
L’apport de cholestérol alimentaire doit être réduit à 300 mg/j. Cet objectif est finalement plus facile à obtenir que la réduction d’acides gras saturés, pourtant essentielle.
Un modèle issu d’une méta-analyse récente suggère une réponse de type exponentiel de la cholestérolémie alimentaire. Au-delà de 500 mg/j, l’équation atteint une asymptote et la cholestérolémie varie relativement peu, pour des apports pouvant être parfois très élevés. Avant ce seuil, la pente de la courbe est très forte, et tout changement dans l’apport de cholestérol influence considérablement la cholestérolémie.
Ce modèle pourrait permettre d’expliquer notamment pourquoi les patients les plus respectueux des règles diététiques pourraient observer des variations importantes de leur cholestérolémie lors d’écarts alimentaires.
Il faut également souligner que les variations de l’apport de cholestérol alimentaire permettent au maximum une variation de la cholestérolémie de 1,3 mmol/l dans le modèle développé précédemment. Enfin, l’effet du cholestérol alimentaire est très variable d’un individu à l’autre.
3.3 L’apport glucidique
L’apport glucidique doit compenser la réduction calorique liée à la restriction en graisse. Il est fondamental de prendre cet élément en compte, car de nombreux régimes sont abandonnés, car hypocaloriques à tort, et mal tolérés par les patients.
Un apport essentiellement composé de glucides complexes est recommandable à environ 50-55 % de la ration calorique totale.
Le rôle hypertriglycéridémiant éventuel de cet apport glucidique a été évoqué et pourrait avoir comme conséquence une réduction du HDL-cholestérol, considérée comme néfaste.
Des études récentes ont permis de montrer que ce phénomène, jusqu’à des apports glucidiques atteignant 60 % de la ration calorique totale, était très modeste, voire inexistant.
Pour des patients ayant une hypercholestérolémie pure et sans surpoids, l’interdiction de sucres simples (saccharose par exemple) est abusive [32].
3.4 L’apport de fibres alimentaires
Un apport de fibres alimentaires d’environ 20 à 30 g/j est également recommandé. Seules les fibres solubles ont démontré une certaine efficacité vis-à-vis de la cholestérolémie, quoique très modeste, puisqu’une réduction d’au maximum 5 % de la cholestérolémie totale peut être attendue.
Ces fibres solubles (principalement guar, pectine, psyllium…) sont assez peu présentes dans notre alimentation occidentale, à l’exception de certains fruits et légumes.
3.5 L’apport de fruits et légumes
L’apport régulier de fruits et légumes doit être recommandé pour leur richesse en vitamines antioxydantes et en fibres alimentaires.
La quantité et la variété de leur apport dans l’alimentation française pourraient expliquer, en partie, la plus faible fréquence des maladies athéromateuses.
3.6 L’apport de protéines
L’apport protéique recommandé est d’environ 15 à 20 % de la ration calorique totale.
Le recours au poisson ou à des viandes maigres permet d’atteindre cet objectif, sans augmenter la consommation lipidique.
Certaines protéines végétales, et en particulier celles du soja, ont une action hypocholestérolémiante.
Dans une méta-analyse récente, une consommation de 40 g/j de protéines de soja permettait d’espérer une réduction du LDL-cholestérol d’environ 10 mg/l [33].
3.7 La consommation d’alcool
La consommation d’alcool, qui n’est pas recommandée dans les RMO peut cependant être tolérée, à des doses relativement limitées.
En effet, il a été démontré dans plusieurs études qu’un apport régulier de vin pouvait avoir un rôle anti-athérogène.
Les molécules antioxydantes présentes dans la composition du vin rouge pourraient expliquer les résultats observés.
De ce fait, une consommation modérée d’alcool correspondant à environ deux verres de vin par jour est tolérable.
4. Conclusion
En conclusion, le niveau de preuves est considéré comme très élevé pour les données suivantes :
- le LDL-cholestérol est un facteur de risque lipidique majeur, qui a le statut de facteur causal de l’athérosclérose et de ses complications ;
- toute baisse du LDL par la diététique, les hypocholestérolémiants ou d’autres mesures (activité physique) s’accompagne d’une diminution du risque cardiovasculaire ;
- il est formellement établi que la diminution du risque cardiovasculaire s’accompagne aussi d’une diminution de la mortalité totale seulement avec les statines ;
- la rentabilité de l’intervention en nombre de patients à traiter pour éviter un événement cardiovasculaire dépend du risque cardiovasculaire de l’individu. Ce risque est fortement relié au nombre de facteurs de risque ;
- le HDL-cholestérol est un marqueur de risque lipidique de grande importance mais, en l’absence d’étude thérapeutique, on ne peut affirmer formellement que son augmentation s’accompagne d’une diminution du risque cardiovasculaire ;
- dans les mesures diététiques, la baisse des graisses saturées est la mesure la plus importante et la plus efficace pour diminuer le LDL-cholestérol et les maladies cardio-vasculaires.
[1] Nieto F.J., Alonso J., Chambless L.E. et coll. Population awareness and control of hypertension and hypercholesterolemia : the Atherosclerosis Risk in Communities Study. Arch Intern Med 1995 ; 155 : 677.
[2] Bruckert É., Emmerich J., Thomas D., Charpak Y., Bichon L., Clergeot A. Influence d’une campagne d’information sur les facteurs de risque cardiovasculaire dans une ville française (Epernon ville d’étude). Rev Epidemiol Sante Publique 1994 ; 42 (2) : 128-37.
[3] Keys A. (ed.). Coronary heart disease in seven countries (American Heart Association, monograph n° 29). Circulation 1970 : 41 (suppl. 1) : 1.
[4] Stamler J., Wentworth D., Neaton J.D. for the MRFIT Research Group. Is the relationship between serum cholesterol and risk of premature death from coronary heart disease continuous and graded ? Findings in 356 222 primary screenees of the Multiple Risk Factor Intervention Trial (MRFIT). JAMA 1986 ; 256 : 2823-8.
[5] Anderson K.M., Castelli W.P., Levy D. Cholesterol and mortality : 30 years of follow-up from the Framingham study. JAMA 1987 ; 257 : 2176.
[6] Ducimetiére P., Richard J., Claude J.R., Warnet J.M. Les cardiopathies ischémiques. Incidence et facteurs de risque. L’étude prospective parisienne. Paris. Editions INSERM, 1981.
[7] Wilson P.W.F., Abbott R.D., Castelli W.P. High density lipoprotein cholesterol and mortality : the Framingham Heart Study. Arteriosclerosis 1988 ; 8 : 737.
[8] Gordon D.J., Probstfield J.L., Garrison R.J. et coll. High density lipoprotein cholesterol and cardiovascular disease : four prospective American studies. Circulation 1989 ; 79 : 8.
[9] Dayton S., Pearce M.L., Hashimoto S., Dixon W.J., Tomiyashu U. A controlled clinical trial of a diet high in unsaturated fat in preventing complications of atherosclerosis. Circulation 1969 ; 39 and 40 (suppl II) : 1-63.
[10] Miettinen M., Turpeinem O., Karnoven M.J., Elosuo R., Paavilainenen E. Effects of cholesterol lowering diet on mortality from coronary heart disease and other causes. A twelve-year clinical trial in men and women. Lancet 1972 ; 2 : 835-8.
[11] Frantz I.D., Dawson E.A., Ashman P.L., Gatewood L.C., Bartsch G.E., Kuba K., Brewer E.R. Test of effect of lipid lowering by diet on cardiovascular risk. The Minnesota Coronary Survey. Artheriosclerosis 1989 ; 9 : 129-35.
[12] Leren P. The Oslo Diet Heart Study. Eleven years report. Circulation 1970 ; 42 : 935-42.
[13] Singh R.B., Rastogi S.S., Verma R. et coll. An indian experiment with nutritional modulation in acute myocardial infarction. Am J Cardiol 1992 ; 69 : 879-85.
[14] Burr M.L., Fehily A.M., Gilbert J.E. et coll. Effects of changes in fat, fish, and fibre intakes on death and myocardial reinfarction : Diet And Reinfarction Trial (DART) Lancet 1989 ; 334 : 757-61.
[15] De Lorgeril M., Renaud S., Mamelle N. et coll. Mediterranean alpha-linolenic acid-rich diet in secondary prevention of coronary heart disease. Lancet 1994 ; 343 : 1454-9.
[16] Lipid Research Clinics program. The Lipid Research Clinics Coronary Primary Prevention Trial results. JAMA 1984 ; 251 : 351-74.
[17] Frick M.H., Elo O., Haapa K. et al. Helsinki Heart Study : primary-prevention trial with gemfibrozil in middle-aged men with dyslipidemia. Safety of treatment, changes in risk factors, and incidence of coronary heart disease. N Engl J Med 1987 ; 317 : 1237-1245.
[18] Committee of principal investigators. A cooperative trial in the primary prevention of ischaemic heart disease using clofibrate. Br Heart J 1978 ; 40 : 1069-118.
[19] Muldoon M.F., Manuck S.B., Matthews K.A. Lowering cholesterol concentrations and mortality : a quantitative review of primary prevention trials. Br Med J 1990 ;301 : 309-314.
[20] Shepherd J., Cobbe S.M., Ford I., Isles C.G., et coll. for the West of Scotland Coronary Prevention Study Group. Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. West of Scotland Coronary Prevention Study Group. N Engl J Med 1995 ; 333 : 1301-1307.
[21] The Coronary Drug Project Reasearch Group. Clofibrate and niacin in coronary heart disease. JAMA 1975 : 231 : 360-81.
[22] Canner P.L., Berge K.G., Wenger N.K., et coll. Fifteen year mortality in Coronary Drug Project patients : long-term benefit with niacin. J Am Coll Cardiol 1986 ; 8 : 1245-1255.
[23] Rossouw J.E., Lewis B., Rifkind B.M. The value of lowering cholesterol after myocardial infarction. N Engl J Med 1990 ; 323 : 1112-1119.
[24] Buchwald H., Varco R.L., Matts J.P. et coll. Effect of partial ileal bypass surgery on mortality and morbidity from coronary heart disease in patients with hypercholesterolemia. Report of the Program on the Surgical Control of the Hyperlipidemias (POSCH). N Engl J Med 1990 ; 323 : 946-955.
[25] Scandinavian Simvastatin Survival Study Group. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease : the Scandinavian Simvastatin Survival Study (4S). Lancet 1994 ; 344 : 1383-1389.
[26] Sacks F.M., Pfeffer M.A., Moye L.A., et coll. The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. N Engl J Med 1996 ; 335 : 1001-1009.
[27] Chatellier G., Zapletal E., Lemaitre D., Menard L, Degoulet P. The number needed to treat : a clinically useful nomogram in its proper context. BMJ 1996 ; 312 : 426-429.
[28] Chair A., Brunzell J.D., Denke MA., et coll. Rationale of the diet-heart statement of the American Heart Association. Report of the Nutrition Committee. Circulation 1993 : 88 : 3008-29.
[29] Dattilo A.M., Kris-Etherton P.M.. Effects of weight reduction on blood lipids and lipoproteins : a meta-analysis. Am J Clin Nutr 1992 ; 56 : 320-8.
[30] Mensink RF, Katan M.B. Effect of dietary fatty acids on serum lipids and lipoproteins. A meta-analysis of 27 trials. Arteriosclerosis and Thrombosis 1992 ; 12 : 911-9.
[31] Hopkins RN. Effects of dietarv cholesterol on serum cholesterol : a meta-analysis and review. Am J Clin Nutr 1992 ; 55 : 1060-70.
[32] Retzlaff B.M.., Walden C.E.., Dowdy A.A. et coll. Changes in plasma triacylglycerol concentrations among free-living hyperlipdemic men adopting different carbohydrate intakes over 2 years : the dietary alternative study. Am J Clin Nutr 1995 ; 62 : 988-95.
[33] Anderson J.W., Johnstone B.P., Cook-Newell M.E. Meta-analysis of the effects of soy protein intake on serum lipids. N Engl J Med 1995 ; 333 276-82.


