par L. LAGROST, D. MASSON, J. CHAPMAN
Les lipides constituent une famille hétérogène de molécules hydrophobes, insolubles dans les milieux biologiques aqueux. Ils sont véhiculés à travers les divers compartiments extracellulaires de l’organisme (plasma, lymphe et liquide interstitiel) au sein d’édifices macromoléculaires complexes : les lipoprotéines.
En fait, les lipoprotéines ne constituent pas in vivo des entités stables, mais elles subissent des remaniements constants durant leur transit dans l’espace intravasculaire.
Les apolipoprotéines, les enzymes lipolytiques, les protéines de transfert et les récepteurs cellulaires vont agir de concert afin de permettre le transport et la distribution des lipides au sein de l’organisme. Dans le présent article sont décrites les trois voies essentielles du métabolisme des lipoprotéines :
- la voie entéro-hépatique, permettant le transport des lipides exogènes de l’intestin vers le foie ;
- la voie d’apport que représente le transport centrifuge des lipides du foie vers les tissus périphériques ;
- et la voie de retour, permettant le transport centripète du cholestérol des tissus périphériques vers le foie et son excrétion biliaire.
Structure et fonction des lipoprotéines
Les lipoprotéines consistent en une vaste famille de particules, initialement subdivisée en plusieurs sous-groupes distincts sur la base de caractéristiques physico-chimiques, formant deux principales classes de lipoprotéines avec des mobilités électrophorétiques comparables à celles des globulines α1 et β.
Tableau 1. Caractéristiques physiques et chimiques des lipoprotéines plasmatiques humaines.
IDL : Intermediate Density Lipoprotein ; EC : esters de cholestérol ; TG : Triglycérides ; nd : non-détectable.
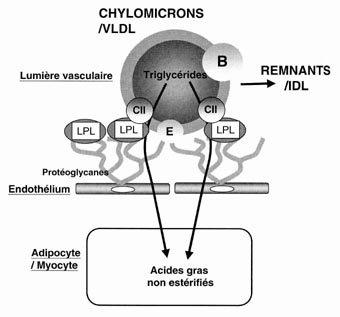
La généralisation de la technique d’ultracentrifugation a permis de proposer une classification plus fine et plus complète des lipoprotéines plasmatiques [1] [2] [3]. Ainsi, si l’on considère la densité hydratée des lipoprotéines, proportionnelle à la quantité de lipides (densité inférieure à 1 g/ml) et de protéines (densité supérieure à 1 g/ml), on distingue aujourd’hui six populations plasmatiques chez la plupart des vertébrés (tableau 1). Cette subdivision a pris toute son importance dès lors que les études cliniques ont révélé que l’incidence des maladies cardiovasculaires est corrélée positivement avec le cholestérol des lipoprotéines de basse densité, alors que la corrélation est au contraire négative avec le cholestérol des lipoprotéines de haute densité (HDL) [4] [5]. Si les sous-populations diffèrent par leur densité et leur taille, elles varient également par leur composition lipidique, notamment celle du cœur hydrophobe. Les lipoprotéines les plus légères (chylomicrons et Very Low Density Lipoprotein ou VLDL) contiennent principalement des triglycérides. Les lipoprotéines de densité plus élevée (LDL et HDL) transportent essentiellement du cholestérol estérifié. Nous verrons plus loin que ce déséquilibre de composition du cœur hydrophobe entre HDL et LDL d’une part et chylomicrons et VLDL d’autre part constitue un véritable moteur dans le métabolisme des lipoprotéines chez beaucoup d’espèces, et notamment chez l’homme.
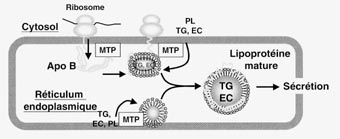
Le cœur lipidique hydrophobe des lipoprotéines, constitué d’esters de cholestérol et de triglycérides, est recouvert d’une enveloppe amphiphile dont les constituants principaux sont les phospholipides, le cholestérol non-estérifié et les apolipoprotéines. Ces dernières confèrent à chaque édifice lipoprotéique ses propriétés fonctionnelles et son devenir métabolique.
Initialement, les apolipoprotéines ont été subdivisées en trois sous-familles distinctes selon la nomenclature A, B et C [6] ; les apoA sont principalement associées aux HDL, les apoB aux LDL et les apoC aux VLDL et HDL. En fait, bien qu’encore couramment utilisée de nos jours, cette nomenclature a considérablement évolué au cours des trente dernières années, en raison de la découverte de nouvelles apolipoprotéines et de profils de distribution spécifiques au sein des lipoprotéines plasmatiques (tableau 2). Par exemple, alors que les apolipoprotéines A-I et A-II se localisent quasi-exclusivement dans les HDL, l’apolipoprotéine A-IV peut aussi s’associer aux lipoprotéines riches en triglycérides ; les apolipoprotéines B se localisent non seulement dans les LDL, mais également dans les VLDL et les chylomicrons : les apoE, comme les apoC, ne sont pas associées à un seul type de lipoprotéines, mais se retrouvent à la fois dans les VLDL et les HDL (tableau 2).
Tableau 2. Identité, expression tissulaire, distribution plasmatique et fonction des principales apolipoprotéines humaines.
Tableau 4. Principales enzymes et protéines de transfert impliquées dans le métabolisme intravasculaire des lipoprotéines.
Tableau 5. Récepteurs cellulaires des lipoprotéines.