M. Lagarde, H. Lafont
Les acides gras consommés dans les aliments sont de nature très variée mais sont majoritairement sous forme estérifiée dans les triglycérides (huiles et graisses alimentaires) et les phospholipides tissulaires d’origine animale ou végétale : ils sont absorbés au niveau du tractus gastro-intestinal après clivage de ces lipides par diverses lipases et phospholipases, puis circulent dans le sang sous forme d’esters (triglycérides, phospholipides, esters de cholestérol) associés aux lipoprotéines et sous forme non-estérifiée principalement liés à l’albumine. Ils sont alors disponibles pour incorporation dans les tissus, l’albumine en étant vraisemblablement le pourvoyeur principal.
Les acides saturés ont un rôle essentiellement énergétique après dégradation en acétyl-CoA par la (3-oxydation mitochondriale. Leur consommation, surtout celle du palmitate, constitue un facteur de risque cardiovasculaire, et de nombreux travaux rapportent le rôle néfaste d’une consommation trop élevée de graisses saturées ou plutôt de graisses présentant un index de polyinsaturation faible (rapport P/S ou polyinsaturés/saturés). Les recommandations actuelles à cet égard sont en faveur d’un rapport P/S se rapprochant de 1 [1] avec un apport calorique en graisses ne dépassant pas un tiers de l’apport calorique total. Ce rapport P/S ne prend pas en compte les apports en acides gras monoinsaturés (essentiellement oléate) qui peuvent représenter une part non négligeable dans les régimes méditerranéens avec huile d’olive. Sur le plan fonctionnel, l’oléate est considéré comme neutre, le rôle protecteur de l’huile d’olive étant plutôt attribué à des composants mineurs, notamment des antioxydants [2]. L’oléate a lui aussi un rôle énergétique, ce qui l’associe sur ce point aux acides gras saturés. Une exception concerne la lipidation de nombreuses protéines intracellulaires qui acquièrent un caractère hydrophobe permettant leur translocation membranaire. C’est le cas notamment de protéines G dont le rôle dans la signalisation cellulaire est bien connu. Cette lipidation a lieu classiquement par le myristate (14:0) (myristoylation d’un résidu Gly N-terminal) ou par le palmitate (16:0), le stéarate (18:0) ou l’oléate (18:1) (réalisation d’un thioester sur un résidu Cys quelconque de la chaîne peptidique). Ce deuxième type de lipidation est souvent appelée palmitoylation en raison de la prédominance du palmitate dans la liaison thioester. Aucune anomalie de ces phénomènes de lipidation n’a cependant été décrite à ce jour, en particulier dans le cadre de l’athérosclérose.
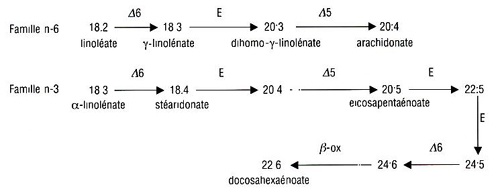
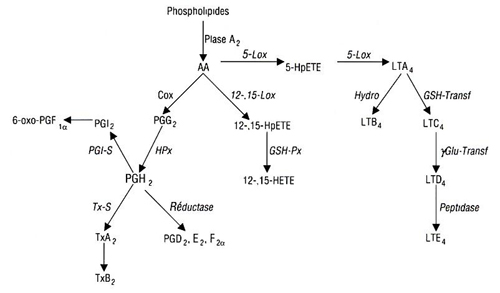
À l’inverse des acides gras saturés et de l’oléate, qui peuvent être synthétisés de novo à partir d’acétyl-CoA, les acides gras polyinsaturés (AGPI) des familles n-6 et n-3 dérivent tous d’un précurseur par famille, que l’organisme ne peut synthétiser et qu’il doit donc ingérer. Les AGPI de ces deux familles ont des métabolismes et fonctions différents qui ne sont pas sans implication dans l’athérogenèse.